메인
배아등 연구자
체세포복제배아 및 단성생식배아 대상 연구자
체세포복제배아등 연구계획서의 승인 및 변경
체세포복제배아등 연구계획서의 승인 및 변경
체세포복제배아등의 연구계획서의 승인 절차
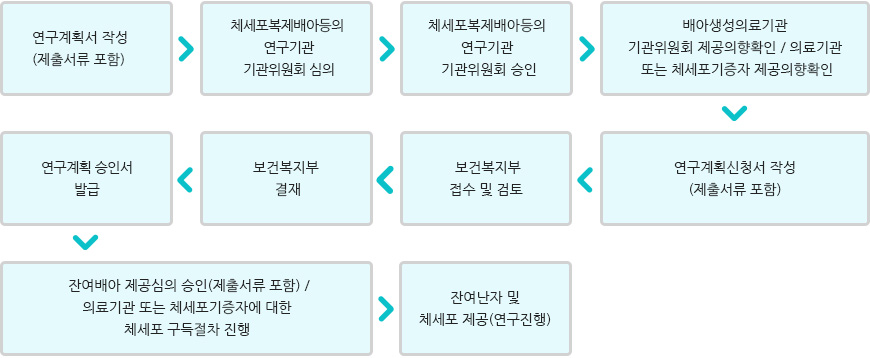
- 01.연구계획서 작성(제출서류 포함)
- 02.체세포복제배아등의연구기관위원회 심의
- 03.체세포복제배아등의연구기관 기관위원회 승인
- 04.배아생성의료기관 기관위원회 제공의향확인/의료기관 또는 체세포기증자 제공의향확인
- 05.연구계획신청서 작성(제출서류 포함)
- 06.보건복지부 접수 및 검토
- 07.보건복지부 결재
- 08.연구계획 승인서 발급
- 09.잔여배아 제공심의 승인(제출서류 포함)/의료기관 또는 체세포기증자에 대한 체세포 구독절차 진행
- 10.잔여난자 및 체세포제공(연구진행)
체세포복제배아등의 연구기관 기관위원회 심의
1) 기관위원회는 생명윤리법 제10조제3항제1호에 따라 다음의 사항을 심의하여야 합니다.
- ① 연구계획서의 윤리적ㆍ과학적 타당성
- ② 잔여난자 및 체세포 기증자로부터 적법한 절차에 따라 동의를 받았는지 여부
- ③ 잔여난자 및 체세포 기증자의 개인정보 보호 대책
- ④ 그 밖에 기관에서의 생명윤리 및 안전에 관한 사항
2) 또한 시행규칙 제28조제1항에 따른 배아연구계획서의 승인 기준에 따라 다음의 사항을 심의하여야 합니다.
- ① 연구의 목적이 생명윤리법에서 허용하고 있는 범위 안에 있을 것
- ② 현재 이용 가능한 치료방법이 없거나 기관위원회가 과학적 타당성을 판단한 결과 현재 이용 가능한 다른 치료방법과 비교하여 현저히 우수할 것으로 예측되는 치료에 관한 연구일 것
- ③ 연구목적에 적합한 잔여난자의 수량 ・형태 등을 제시할 것
- ④ 연구책임자 및 연구담당자가 해당 연구분야의 자격과 경력을 갖추었을 것
- ⑤ 해당 연구를 수행하기에 적합한 연구시설 및 장비를 갖출 것
- ⑥ 연구기간이 해당 연구를 수행하기에 충분할 것
- ⑦ 기관위원회의 적절한 심의과정을 거쳤을 것
- ⑧ 잔여난자 및 체세포에 대한 적절한 수집계획을 갖출 것
3) 기타 관련 사항에 대한 설명은 체세포복제배아등의 연구기관 기관위원회 항목 참고
배아생성의료기관 기관위원회의 제공의향 확인
- 1) 체세포복제배아등의 연구기관의 연구자는 연구계획서에 대한 보건복지부장관의 승인을 얻기 전,해당 연구계획서, 잔여난자의 이용계획서, 연구계획에 대한 연구기관 기관위원회의 심의서를 배아생성의료기관에 제출하여 배아생성의료기관에서의 잔여배아 등의 제공 의향을 확인하여야 합니다.
- 2) 연구자로부터 이용계획서와 그에 관련된 서류를 제출받은 배아생성의료기관은 기관위원회의 심의를 통해 잔여난자 의 제공여부를 1차적으로 결정 할 수 있습니다.
보건복지부장관의 승인
체세포복제배아등의 연구기관이 체세포복제배아등을 생성하거나 연구를 하려면 생명윤리법 제31조제4항에 따라 보건복지부장관에게 체세포복제배아등 연구계획서를 제출하여 승인을 받아야 합니다.
1) 제출서류
- ① 연구계획 승인신청서(시행규칙 별지 제23호 서식)
- ② 배아연구의 목적, 방법, 기간, 연구책임자 및 연구담당자의 성명 및 경력 등이 포함된 배아연구계획서
- ③ 배아연구계획서에 대한 기관위원회의 심의 결과에 관한 서류
- ④ 연구에 이용되는 잔여난자의 수량·수집방법 등이 포함된 이용계획서
2) 보건복지부의 업무
- ① 생명윤리법 제30조 제3항에 따라 다른 중앙행정기관의 장이 연구비를 지원하는 연구기관으로부터 연구계획서를 제출 받았을 때에는 승인 여부를 결정하기 전에 그 중앙행정기관의 장과 협의하여야 합니다.
- ② 제출된 서류를 심사하기 위하여 관련 전문가에게 자문 할 수 있습니다.
- ③ 연구계획서를 승인할 때에는 연구계획 승인서(시행규칙 별지 제24호 서식)를 발급하여야 합니다.
3) 배아연구계획서의 승인기준
시행규칙 제28조제1항에 따른 배아연구계획서의 승인 기준은 다음과 같습니다.
- ① 연구의 목적이 생명윤리법에서 허용하고 있는 범위 안에 있을 것
- ② 현재 이용 가능한 치료방법이 없거나 기관위원회가 과학적 타당성을 판단한 결과 현재 이용 가능한 다른 치료방법과 비교하여 현저히 우수할 것으로 예측되는 치료에 관한 연구일 것
- ③ 연구목적에 적합한 잔여난자의 수량 ・형태 등을 제시할 것
- ④ 연구책임자 및 연구담당자가 해당 연구분야의 자격과 경력을 갖추었을 것
- ⑤ 해당 연구를 수행하기에 적합한 연구시설 및 장비를 갖출 것
- ⑥ 연구기간이 해당 연구를 수행하기에 충분할 것
- ⑦ 기관위원회의 적절한 심의과정을 거쳤을 것
- ⑧ 잔여난자에 대한 적절한 수집계획을 갖출 것
배아생성의료기관 기관위원회의 제공심의에 의한 잔여배아 제공
1) 시행규칙 제22조제2항에 따라 연구자는 보건복지부장관의 승인을 받은 연구계획서를 바탕으로 배아생성의료기관으로부터 해당 연구에 필요한 잔여난자를 제공받기 위해 다음의 서류를 배아생성의료기관의 장에게 제출하여야 합니다.
- ① 보건복지부장관의 체세포복제배아 등의 연구계획승인서 사본
- ② 최종 승인된 잔여 배아이용계획서
- ③ 배아생성의료기관 기관생명윤리위원회는 생명윤리서약서 또는 그 밖에 심의에 필요한 서류를 연구자에게 추가로 요청할 수 있습니다.
2) 배아생성의료기관 기관위원회에서 잔여배아의 제공을 위해 심의해야 할 사항은 다음과 같습니다.
- ① 제출받은 체세포복제배아등 연구계획서의 승인여부 및 최종 승인된 연구계획서인지 여부
- ② 잔여난자 이용계획서를 검토하여 이용 목적, 수량,제공 방법 등의 타당성(적정성) 여부
- ③ 연구목적 제공을 위해 보관중인 잔여난자가 연구를 위해 이용될 수 있는 잔여난자인지 여부
3) 제공 여부 통보
- - 배아생성의료기관 기관위원회는 위의 사항을 심의한 후, 제공 여부를 결정하여 결정된 바를 해당 연구기관에 승인결과를 7일 이내에 통보합니다.
체세포복제배아등의 연구계획서 변경
체세포복제배아등의 연구계획서 내용 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 보건복지부장관에게 연구계획서를 제출하여 승인을 받아야 합니다.
1) 대통령령으로 정하는 중요한 사항이란 시행령 제13조에 따라 다음과 같습니다.
- ① 연구의 목적 또는 기간
- ② 연구에 필요한 잔여난자의 수량
- ③ 잔여난자를 제공하는 배아생성의료기관
- ④ 연구책임자
2) 제출서류
- ① 연구계획 변경승인 신청서(시행규칙 별지 제25호 서식)
- ② 연구계획 변경서
- ③ 변경사항에 대한 기관위원회의 심의결과에 관한 서류
3) 승인절차

- 01.연구계획 변경승인 신청서 작성(제출서류 포함)
- 02.보건복지부 접수 및 검토
- 03.보건복지부 결재
- 04.연구계획 변경승인서 발급
4) 보건복지부장관이 체세포복제배아등의 연구계획서의 변경을 승인할 때에는 연구계획 변경승인 승인서(시행규칙 별지 제26호 서식)를 발급하여야 합니다.